产品中心
倍谙基已针对不同细胞自主研发的近百款目录型无血清培养基,适用于抗体蛋白表达、疫苗生产及细胞与基因治疗等多个领域。
时间:2023年12月08日
流感病毒疫苗生产工艺
近期,呼吸道疾病进入高发时期,流感、新冠、支原体、RSV和腺病毒等多种病原体叠加,以流感为主。根据我国国家流感中心编制的流感监测周报2023年第47周(2023.11.20~2023.11.26)的数据,南方和北方省份流感样病例比例分别为8.0%和7.1%,显著高于往年同期(如下表),并成上升趋势(如下图)。
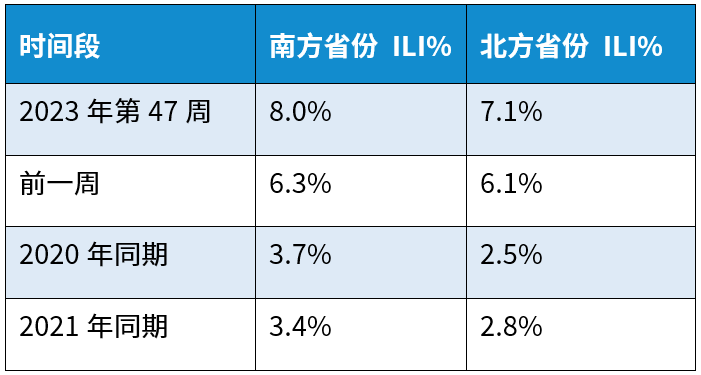

来源:流感监测周报第47期
同时对流感样病例样本检测显示流感病毒检测阳性率也持续上升,南方和北方省份阳性率分别为44.3%和36.9%,均以A(H3N2)亚型为主,其次为B(Victoria)系(如下表和下图)。
流感样病例监测实验室检测
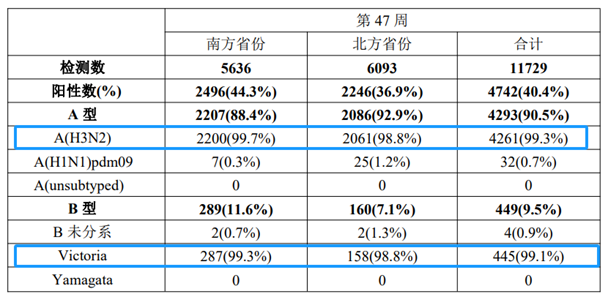
来源:流感监测周报第47期
南方省份流感样病例标本检测结果
流感疫苗
流感是由流感病毒引起的急性呼吸道传染病,人群普遍易感,流感的每年季节性流行可导致全球300万~500万重症病例,29万~65万呼吸道疾病相关死亡,对人类健康造成了严重威胁。流感病毒根据核蛋白和基质蛋白不同,主要分为甲(A)、乙(B)、丙(C)、丁(D)型,均可感染人类。甲型流感病毒根据病毒表面的血凝素(HA)和神经氨酸酶(NA)的蛋白结构和基因特性,分为多种亚型,目前已发现有18个HA亚型(H1~18)和11个NA亚型(N1~11)。乙型流感病毒根据HA基因型分为Victoria系和Yamagata系。由于2020 年3月至今,全球几乎未再监测到自然流行的乙型Yamagata 系毒株,因此现在引起流感的病毒主要是甲型流感病毒中的H1N1、H3N2亚型及乙型流感病毒中的Victoria系。
接种流感疫苗是预防流感、降低流感相关重症和死亡负担最经济有效的措施,全球已上市的流感疫苗包括灭活疫苗、减毒活疫苗和重组疫苗。按照所含组份,分为三价和四价流感疫苗,三价流感疫苗含有A(H3N2)亚型、A(H1N1)pdm09亚型和B型流感病毒株的一个系,四价流感疫苗含有A(H3N2)亚型、A(H1N1)pdm09亚型和B(Victoria)系、B(Yamagata)系。2023-2024流行季我国使用的流感疫苗包括三价灭活流感疫苗(IIV3)、四价灭活流感疫苗(IIV4)和三价减毒活疫苗(LAIV3)。
流感疫苗生产工艺
传统鸡胚培养生产流感疫苗的局限性
流感疫苗包括基于鸡胚培养和基于细胞培养的生产工艺,目前应用最广泛的流感疫苗生产工艺是利用鸡胚培养流感病毒,但在时间灵活性和疫苗产量方面都具有局限性。鸡胚存在原材料供应不稳定和生产周期长等缺点,基于鸡胚法的疫苗生产将难以在短时间内生产数十亿剂疫苗,而且基于鸡胚生产的其他疫苗也将出现短缺。
基于细胞培养的流感疫苗生产工艺成为趋势
与传统基于鸡胚的工艺相比,细胞培养生产系统能够在短时间内生产大量疫苗,并可以显著提高人们应对流行病和新出现的病毒性疾病的能力。例如,制备单剂量基于鸡胚的疫苗需要1-2个受精的鸡胚,即大规模的流感疫苗生产至少需要数百万个受精的、带胚的鸡蛋,这些都需要提前准备。在基于细胞培养的生产工艺中,细胞作为起始材料是可以储存后随时使用的。

Safety of MDCK cell culture-based influenza vaccines,
Future Medicine, 2011
除此之外,鸡蛋中培养的流感病毒可能会发生适应鸡蛋的基因突变,包括抗原HA的突变,这有助于病毒在鸡蛋中的感染和复制,但导致与最初临床分离的病毒不完全一致,疫苗效力可能会下降。但在MDCK(Madin–Darby canine kidney)细胞中尚未观察到细胞特异性的适应性突变,与最初临床分离的病毒一致,确保了疫苗的效力(如上图)。因此使用动物细胞培养生产流感疫苗得到了越来越多的关注和应用,正在逐步取代传统的基于鸡胚的生产工艺。
MDCK细胞是流感病毒疫苗生产最佳选择之一
选择用于生产灭活流感疫苗的细胞系时,细胞系必须对多种流感病毒具有感染性并支持高滴度病毒复制。MDCK细胞对目前已知的所有流感疫苗病毒,包括禽流感、猪流感和马流感株都具有易感性,并且可以获得高病毒产量,大部分基于细胞培养的流感疫苗的制造商会选择MDCK细胞,例如例如Solvay、Seqirus(原Novartis)和SK Chemicals等公司已成功推出基于MDCK细胞的流感疫苗,分别在荷兰(2001年)、美国FDA(2016)和韩国(2015年)获批上市。目前我国还没有基于细胞培养的流感疫苗获批上市,但已有多家疫苗企业布局MDCK细胞基质流感疫苗生产并已有获批进入临床阶段(如下图)。
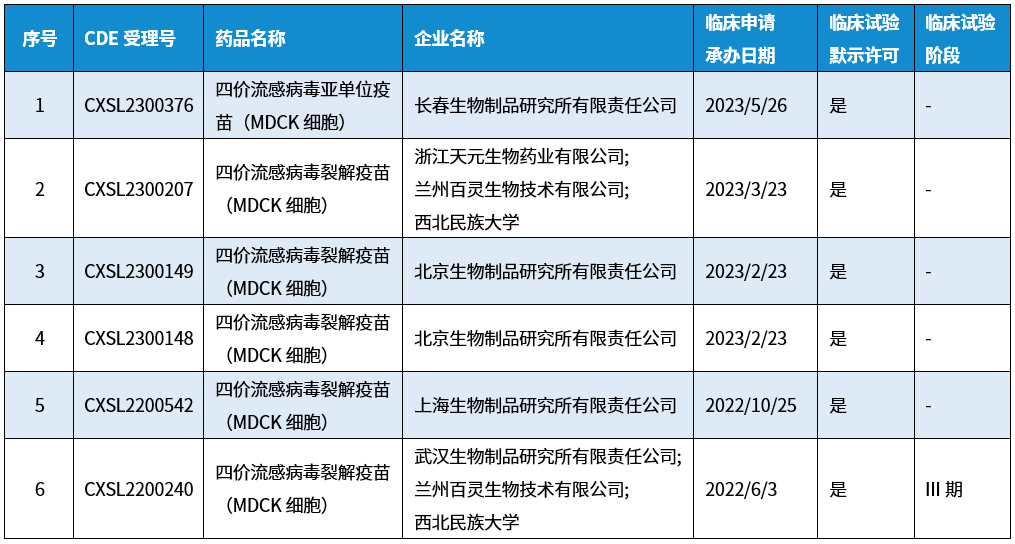
倍谙基生物研发团队自1995年就开始对MDCK细胞培养技术进行研究,凭借近40年来积累的培养基技术和在疫苗生产企业现场提供技术服务的经验,不断改进MDCK产品,推出了Xeno系列MDCK细胞无血清培养基产品,为人用流感疫苗的生产工艺提供了一种高效的替代方案,支持从传统的鸡胚培养转向高效率的悬浮细胞培养。并创造了多个国内外创新突破性项目,例如在2016年就将MDCK细胞无血清全悬浮培养技术成功应用在禽流感疫苗生产中,产量提高了6~8倍;以及近几年支持国内疫苗生产商利用MDCK细胞无血清全悬浮培养技术用于人流感疫苗开发和生产。倍谙基在MDCK细胞无血清培养基开发和培养工艺方面已发表多篇文献和专利(可参考文末论文列表)。
围绕MDCK细胞无血清培养基开发和培养工艺
倍谙基已发表文献
1. Qian Ye, Thu Phan, Wei-Shou Hu, Xuping Liu, Li Fan, Wen-Song Tan, Liang Zhao. Transcriptomic Characterization Reveals Attributes of High Influenza Virus Productivity in MDCK Cells. Viruses, 2021, 13(11): 22002. Thomas Bissinger, Yixiao Wu, Pavel Marichal-Gallardo.Towards integrated production of an influenza A vaccine candidate with MDCK suspension cells. Biotechnology and Bioengineering, 2021, 118(10): 3996-40133. Yixiao Wu, Xuping Liu, Udo Reichl, Wen-Song Tan. High cell density perfusion process for high yield of influenza A virus production using MDCK suspension cells. Applied Microbiology and Biotechnology, 2021, 105(4): 1-144. Yixiao Wu, Hanjing Jia, Xuping Liu,Wen-Song Tan. Highly Efficient Production of an Influenza H9N2 Vaccine Using MDCK Suspension Cells. Bioresources and Bioprocessing, 2020, 7: 635. Thomas Bissinger, Johannes Fritsch, Adrian Mihut, Yixiao Wu, Xuping Liu, Yvonne Genzel, Wen-Song Tan, Udo Reichl. Semi-perfusion cultures of suspension MDCK cells enable high cell concentrations and efficient influenza A virus production. Vaccine, 2019, 37(47): 7003-70106. Luo Jian, Liu Xu-ping, Xiong Fei-fei, Gao Fei-xia, Yi Ying-lei, Zhang Min, Chen Ze, Tan Wen-song. Enhancing Immune Response and Heterosubtypic Protection Ability of Inactivated H7N9 Vaccine by Using STING Agonist as a Mucosal Adjuvant. Frontiers in Immunology, 2019, 10: 22747. Ding Huang, Wen-Juan Peng, Qian Ye, Xu-Ping Liu, Liang Zhao, Li Fan, Kang Xia-Hou, Han-Jing Jia, Jian Luo, Lin-Ting Zho. Serum-Free Suspension Culture of MDCK Cells for Production of Influenza H1N1 Vaccines. PLOS ONE, 2015, 10(11): e01416868. Ding Huang, Kang Xia-Hou, Xu-Ping Liu, Liang Zhao, Li Fan, Zhaoyang Ye, Wen-Song Tan, Jian Luo, Ze Chen. Rational design of medium supplementation strategy for improved influenza viruses production based on analyzing nutritional requirements of MDCK Cells. Vaccine, 2014, 32(52): 7091-7097
倍谙基拥有专业的技术服务团队,为广大生物制药企业提供从细胞培养工艺开发与优化、培养基配方设
计到培养基加工制造的高品质一站式服务。如有任何问题,请点击留言,我们将会尽快回复您。
您也可以致电
+86-21-68582660